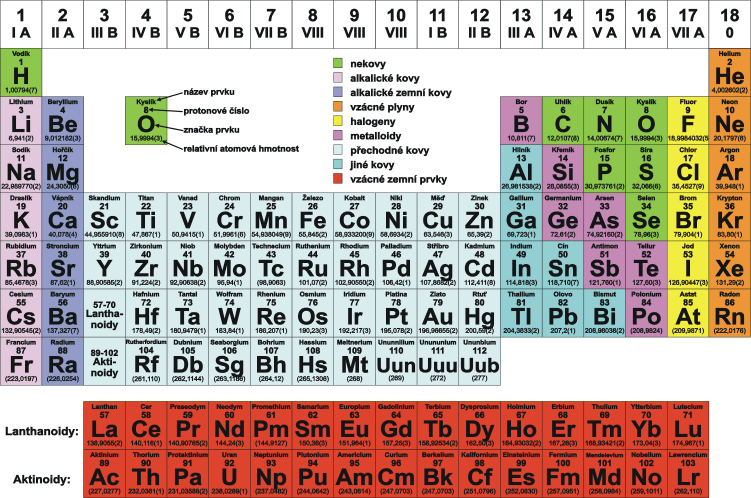
Periodická tabulka
- Charakteristika
Dnes je známo, že některé lehčí prvky jsou až za těžšími (jod stojí za tellurem). Proto roku 1913 Henry Moseley opravil periodický zákon podle rostoucích protonových čísel. V tabulce je obvykle kromě chemického symbolu prvku uvedeno i jeho atomové číslo, relativní atomová hmotnost, případně další údaje o prvcích. V současné době je v tabulce 118 známých prvků, z nichž 94 se přirozeně vyskytuje na Zemi, zbylé byly připraveny pouze uměle a nemají žádný stabilní izotop.
Základem uspořádání prvků je jejich seskupení podle elektronového obalu tak, aby ve skupinách nad sebou ležely prvky se stejným počtem valenčních elektronů. Přitom platí, že prvky, nacházející se ve společné skupině, vykazují i podobné chemické vlastnosti. Někde bývá zvykem dělení skupin na hlavní a vedlejší, prvky v hlavních skupinách mají valenční elektrony ve sférách sa p, prvky vedlejších skupin doplňují valenční elektrony do slupek d a f.
Příkladem skupiny prvků jsou alkalické kovy, které (spolu s vodíkem) zaujímají místo v 1. skupině a mají vždy pouze jeden valenční elektron ve slupce s. Jiným příkladem jsou halogeny, prvky nacházející se v 7. hlavní skupině prvků se sedmi valenčními elektrony – dvěma ve slupce s a 5 ve sféře p.
Pro snadnější zapamatování skupin prvků v periodické tabulce se užívají mnemotechnické pomůcky.
Typy tabulek
- Krátká tabulka – skupiny A a B jsou dohromady
- Dlouhá tabulka – klasická, nejčastěji používaná (lanthanoidy a aktinoidy jsou oddělené)
- Velmi dlouhá tabulka – lanthanoidy a aktinoidy jsou vmezeřeny mezi s-prvky a d-prvky
- Mendělejevova tabulka – zavedl Dmitrij Mendělejev v roce 1869 s Lotharem Meyerem
- Wernerova tabulka – zavedl Alfred Werner v roce 1905 na základě tabulky Mendělejevovy
- Spirální tabulky